بایگانی
- آذر ۱۳۹۵ (۱۶)
- آبان ۱۳۹۵ (۳۸)
- مهر ۱۳۹۵ (۳۴)
- شهریور ۱۳۹۵ (۲۶)
- مرداد ۱۳۹۵ (۸)
- تیر ۱۳۹۵ (۱۴)
خلاصه آمار
پيوندها
۳۴ مطلب در مهر ۱۳۹۵ ثبت شده است
براستی چرا؟
هرساله بیش از 500/000 نفر در کنکور سراسری گروه آزمایشی علوم تجربی شرکت می کنند و صادقانه بگویم تقریبا همه می خواهند در رشته های برتر این گروه، یعنی دندانپزشکی، پزشکی ، داروسازی و رشته تازه بسیار محبوب شده فیزیوتراپی پذیرفته شوند. اما در واقعیت تقریبا 1 درصد از این افراد در رشته و دانشگاه مورد نظرشان پذیرفته می شوند.
در بین پذیرفته نشدگان، خیلی ها از کتاب های کمک آموزشی (درس نامه و تست) خوب و استاندارد استفاده کرده اند، اغلب در کلاس های دبیران برتر با هزینه های آن چنانی شرکت کرده و عده ای از دی وی دی های نسبتا گران موسسات معتبر کنکور بهره برده اند. شمار زیادی از مشاور تحصیلی و کنکور استفاده می کردند و دسته انبوهی از این همایش به آن همایش می رفتند. حساب شرکت کنندگان در آزمون های آزمایشی که گاهی شمار آن ها از شمار شرکت کنندگان در کنکور بیشتر بوده، نیز مشخص است.
به نظر شما دلیل این عدم موفقیت ها چیست؟ آیا داوطلبین به انداره کافی تلاش نکرده اند؟ برنامه ریزی نداشته اند یا مسیر را اشتباه رفته اند؟ خوب درس نخوانده اند و یا درس خوب نخوانده اند؟ آیا انگیزه کافی و هدف مشخص در آنها وجود نداشته است؟ آیا کتاب های کمک آموزشی که خوانده شده خوب نبوده اند و یا فلان کتاب از انتشارات بهمان کلید موفقیت بوده است؟ آیا کلاس ها مفید نبوده و یا تعداد دی وی دی های موسسات آموزشی کنکور کافی نبوده؟ مشاوره ضعیف عمل کرده و یا همایش ها بازده کافی را نداشته؟ شاید سوالات کنکور بسیار سخت و غیر استاندارد بوده و یا احتمالا سوالات آزمون های آزمایشی هیچ شباهتی به سوالات کنکور سراسری نداشته است!
نظرات خود را با ما درمیان بگذارید.
دیدگاه
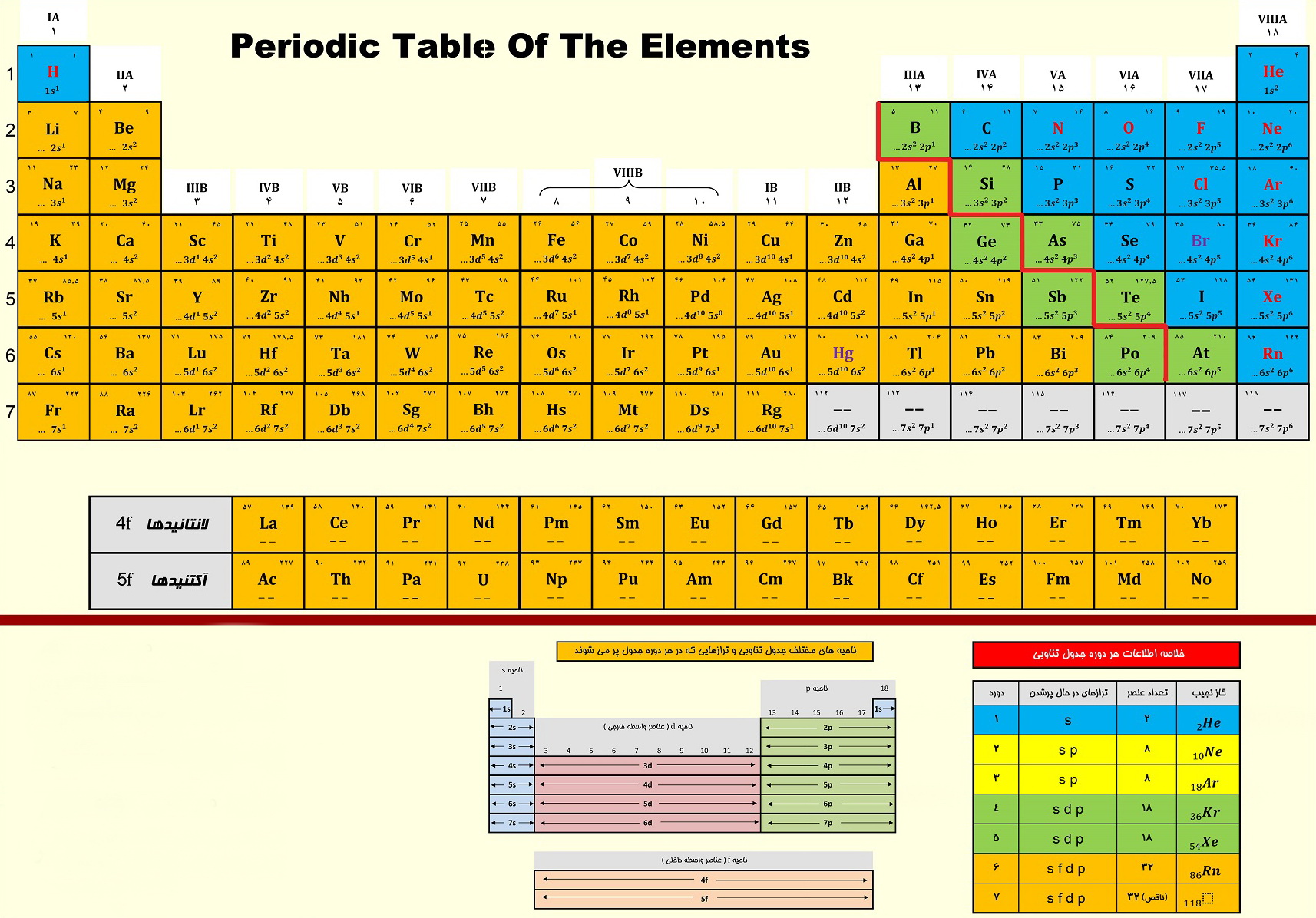
همه چیز درباره جدول تناوبی عناصر، ویژه کنکور
منابع کمک آموزشی وِیژه دروس اختصاصی کنکور
تغییرات خواص عناصر در دوره ها و گروه های جدول:
1) در هر گروه از جدول تناوبی از بالا به پایین شعاع اتمی ویونی افزایش می یابد. از چپ به راست در هر تناوب کاهش می یابد.
2) در هر گروه از جدول تناوبی از بالا به پایین برخصلت فلزی عناصر افزوده و از چپ به راست خصلت فلزی کاسته می شود.
3) در هر گروه از جدول تناوبی از بالا به پایین بار مؤثر هسته افزایش می یابد. همواره بین شعاع با بار مؤثر هسته و نیز انرژی یونش رابطه ی وارونه وجود دارد.
4) در هر گروه از جدول تناوبی از بالا به پایین اثر پوششی الکترون های درونی زیاد می شود. در هر دوره از چپ به راست تعداد لایه های الکترونی و نیز میزان اثر پوششی الکترون های درونی ثابت می ماند.
5) در هر گروه از جدول تناوبی از بالا به پایین با افزایش اندازه اتم، انرژی یونش کاهش می یابد. و در هر دوره از چپ به راست انرژی یونش افزایش می یابد. در یک دوره کمترین انرژی یونش مربوط به فلزات قلیایی و بیشترین انرژی یونش مربوط به گازهای نجیب می باشد.
6) در هر گروه از جدول تناوبی از بالا به پایین مقدار الکترونگاتیوی کاهش می یابد و در هر دوره از چپ به راست الکترونگاتیوی افزایش می یابد. بیشترین الکترونگاتیوی مربوط به فلوئور (4) و کمترین الکترونگاتیوی از آن سزیم (0/7) است.
7) تغییرات دمای ذوب یا جوش: در هر دوره دمای ذوب و جوش تا اندازه ای به طور تناوبی تغییر می کند ولی این روند منظم نیست و در مورد عناصرگروه ها نیز روند واحدی وجود ندارد.
8) در هر دوره با افزایش عدد اتمی انرژی الکترون خواهی افزایش می یابد و در هر گروه با افزایش عدد اتمی اصولا انرژی الکترون خواهی از بالا به پایین کم می شود .
9) تغییر تعداد الکترون های لایه ظرفیت و عدد اکسایش: در هر دوره از عنصری به عنصر دیگر یک واحد به تعداد الکترون های ظرفیت افزوده می شود و تعداد این الکترون ها و عدد اکسایش در عنصرهای هر گروه با هم برابرند.
10) تغییرات پتانسیل الکترودی: در ازای هر دوره با افزایش عدد اتمی توانایی کاهندگی عنصرها کاهش می یابد و توانایی اکسیدکنندگی آنها افزایش می یابد. از این رو فلزهایی که در سمت چپ دوره ها جای دارند خاصیت کاهندگی و نا فلزهایی که در سمت راست دوره ها جای دارند توانایی اکسیدکنندگی دارند. در مورد عناصر یک گروه توانایی اکسیدکنندگی با افزایش عدد اتمی و پتانسیل کاهش می یابد.
11) تغییرات توانایی بازی هیدروکسید: توانایی بازی هیدروکسید عناصر در گروه ها از بالا به پایین افزایش می یابد اما در دوره از سمت چپ به راست رو به کاهش است.
12) در یک دوره روند تغییرات انرژی یونش در گروه دوم و سیزدهم و نیز پانزدهم و شانزدهم انحراف وجود دارد.
13) در فلزات قلیایی از بالا به پایین واکنش پذیری افزایش می یابد.
14) دوره ی اول جدول تناوبی با 2 عنصرکوتاه ترین دوره و دوره ششم به 32 عنصر بلند ترین دوره جدول می باشد. بلندترین گروه جدول تناوبی: گروه سوم با 32 عنصر است.
15) گروه هالوژن ها تنها گروهی از جدول تناوبی که به هر سه حالت جامد، مایع وگاز وجود دارند.
کوتاه اما خواندنی:
سبکترین ذره زیر اتمی : الکترون
واکنش پذیرترین فلزها : فلزهای قلیایی
واکنش پذیرترین نافلزها : هالوژنها
سبکترین فلز : لیتیم
مشهورترین فلز قلیایی خاکی : کلسیم
مشهورترین اکتنید : اورانیم
فراوانترین عنصرهای موجود در پوسته زمین : سیلیسیم و اکسیژن
فراوانترین فلز هسته ی زمین: آلومینیوم.
فراوانترین عنصر جهان : هیدروژن
فراوانترین ترکیب هیدروژن : آب
سبکترین عنصر : هیدروژن
کمترین الکترونگاتیوی : سزیم
بیشترین الکترونگاتیوی : فلوئور
کمترین انرژی نخستین یونش : سزیم
بیشترین انرژی نخستین یونش : هلیم
ساده ترین ترکیب های آلی : هیدروکربنها
ساده ترین هیدروکربنها : الکانها
اربیتال با کمترین انرژی در هر تراز انرژی : اربیتال کروی S
اتم هیدروژن تنها اتمی است که هسته ی آن فاقد نوترون می باشد.
گازهای نجیب به طور کلی واکنش ناپذیرترین عناصر جدول می باشند.
فلوئور واکنش پذیرترین نافلز و بیشترین الکترونگاتیوی را دارد.
تنها فلز مایع: جیوه و تنها نافلز مایع: برم .
مهمترین نکته در جدول تناوبی : تشابه آرایش الکترونی عنصرهای یک خانواده در بسیاری گروه های جدول
شعاع اتمی: هیدروژن با شعاع اتمی 37 پیکومتر کوچکترین و فرنسیم با شعاع اتمی 283 پیکومتربزرگترین شعاع را دارد و بعد از هیدروژن، فلئورکوچکترین شعاع را دارد.
سبک ترین و سنگین ترین عناصر: اسمیم با چگالی 22.48 گرم بر سانتیمتر مکعب سنگین ترین عنصر و هیدروژن با چگالی 0.0899 گرم بر لیتر سبکترین عنصر است.این عنصر به علت سبک بودن در جو زمین یافت نمی شود.
دمای ذوب وجوش: هلیم پایین ترین دمای ذوب( 272.2 - درجه سلسیوس ) و پایین ترین دمای جوش( 268.9 درجه سلسیوس) و تنگستن بالاترین دمای ذوب( 3409 درجه سلسیوس) وبالاترین دمای جوش 5659 درجه سلسیوس) را دارد.
رسانایی الکتریکی و قابلیت تورق: این خواص به عناصر فلزی مربوط می شود و در بین فلزات طلا بیشترین رسانایی الکتریکی و بیشترین قابلیت تورق را دارد. با یک گرم طلا می توان ورقه ای با سطح یک متر مربع ساخت است که ضخامت آن تنها 230 اتم باشد این خواص زاییده آرایش الکترونی این عناصر می باشد.
آلوتروپی: بسیاری از عناصر دارای آلوتروپ هستند که از بین آنها گوگرد بیشترین آلوتروپ را دارد(حدود 14 عدد)کربن ،فسفر و بور نیز مانند گوگرد دارای آلوتروپ هستند.
الکترونگاتیوی: فلئور بیشترین و سزیم کمترین الکترونگاتیوی را دارد .در بین فلزات طلا بیشترین الکترونگاتیوی ( 2.4 ) را داردکه حدود الکترونگاتیوی گوگرد و ید است به همین دلیل اخیرا ترکیباتی مانندCs+ وAu- ساخته شده است.
عنصری که بیشترین تعداد ترکیبات را دارد: هیدروژن (در ترکیبات آلی و معدنی) و پس از آن کربن (در ترکیبات آلی)است.
بیشترین ایزوتوپ: زنون دارای بیشترین تعداد ایزوتوپ می باشد ( 26 عدد) که عدد جرمی آنها از 118 تا 143 تغییر می کند.
خطرات : فلئور و کلر سمی اند. فسفر، هیدروژن و فلزات قلیایی آتشگیر و برم خورنده است.Cr, Ni, As, Cd می توانند باعث ایجاد سرطان گردند. عناصر اکتنید و همچنین کاتیون های عناصر Po, At, Rn, Fr, Ra, Pm پرتوزایند.
وفور در قشر زمین: از بین همه عناصر فقط 7 عنصر دارای وفور بیش از 1% هستند که عبارتند از: O, Si, Fe, Al, Ca, Mg, Na (اکسیژن از همه عناصر بیشتر است و حدود 45.5 % قشر زمین است). Tc, Pm و عناصر با عدد اتمی 93 به بالا در زمین یافت نمی شوند.
بالاترین رسانایی گرمایی،سختی و انبساط طولی: انتظار می رود که این سه خاصیت به فلزات تعلق داشته باشد ولی الماس با ساختمان مشبک بیشترین رسانایی گرمایی را دارد .( پنج برابر فلز مس) به همین دلیل مته ها و اره های ساخته شده از الماس بیش از حد داغ نمی شوند. علاوه براین الماس سخت ترین ماده شناخته شده و کمترین ضریب انبساط طولی را دارد.در صورتی که پتاسیم و روبیدیم بیشترین انبساط را در اثر گرما پیدا می کنند.
بیشترین نیم عمر: تمام ایزوتوپ های اکتنید ها پرتوزایند و از میان آنها عناصر توریم و اورانیوم به ترتیب بیشترین نیم عمرها را دارند.
قدیمی ترین عناصر: قدیمی ترین عناصرهفت فلز معروف یعنی آهن،مس،نقره ،طلا ،قلع ،سرب و جیوه هستند که در دوران باستان کشف شده اند علاوه بر انها دو عنصر کربن و گوگرد نیز به عناصر دوران باستان تعلق دارند.
آشنایی با چند مفهوم ساده در شیمی
منابع کمک آموزشی وِیژه دروس اختصاصی کنکور
خاصیت فلزی و نافلزی :
در هر دوره از چپ به راست خاصیت فلزی کاهش می یابد و خاصیت نافلزی افزایش می یابد. به بیان بهتر در هر دوره با افزایش عدد اتمی واکنش پذیری فلز کاهش می یابد و واکنش پذیری نافلز افزایش می یابد .
همچنین در هر گروه از بالا به پایین خاصیت فلزی افزایش و خاصیت نافلز کاهش می یابد. یعنی از بالا به پایین واکنش پذیری فلز افزایش می یابد و واکنش پذیری نافلز کاهش می یابد .
بار مؤثر هسته :
به بار مثبتی که یک الکترون در فاصله معینی از هسته احساس می کند بار موثر هسته برای آن الکترون گویند.
روند تغییرات بار مؤثر هسته ی اتم در جدول :
در هر دوره (تناوب) از چپ به راست بار موثر هسته روی الکترون های بیرونی افزایش می یابد : چون از چپ به راست عدد اتمی افزایش می یابد ولی اثر پوششی الکترون های درونی تغییر نمی کند در نتیجه جاذبه هسته بر الکترون های لایه ظرفیت بیشتر می شود
در هر گروه از بالا به پایین بار موثر هسته افزایش می یابد : چون از بالا به پایین عدد اتمی افزایش می یابد ( اثر آن روی بار مؤثر به اندازه اثر پوششی الکترون های درونی نیست ) و از طرفی اثر پوششی الکترون های درونی افزایش می یابد در نتیجه جاذبه هسته بر الکترون های لایه ظرفیت کاهش می یابد .
اثر پوششی:
الکترونی که در لایه بیرونی قرار دارد تمام بار هسته را احساس نمی کند زیرا الکترون های لایه درونی مقداری از جاذبه هسته بر الکترون های لایه ظرفیت می کاهند (به عبارت دیگر به کاهش جاذبه هسته بر الکترون های لایه ظرفیت توسط الکترون های لایه درونی).
در هر گروه از جدول تناوبی از بالا به پایین اثر پوششی الکترون های درونی زیاد می شود. در هر دوره از چپ به راست تعداد لایه های الکترونی و همچنبن میزان اثر پوششی الکترون های درونی ثابت می ماند.
شعاع اتمی ( اندازه اتم ):
شعاع اتمی یک عنصر شیمیایی معیاری برای اندازهگیری اندازه اتم است که عموماً فاصله میانگین هسته تا مرز ابر الکترونی در نظر گرفته میشود. الکترونها در محدودههایی حرکت میکنند که شبیه ابر به نظر میرسد. همین نشان دهنده دشواری اندازهگیری شعاع اتمی خواهد بود، زیرا این مرز مشخص نیست.
عوامل مؤثر بر شعاش اتمی :
1- تعداد لایه های الکترونی : هر چه تعداد لایه های الکترونی بیشتر باشد شعاع اتمی بیشتر و بر عکس
2- بار مؤثر هسته : هر چه بارمؤثر هسته روی الکترون های لایه بیرونی بیشتر باشد این الکترون ها بیشتر به سمت هسته کشیده می شوند و شعاع اتمی کاهش می یابد .
روند تغییرات شعاع اتمی در جدول :
در هر دوره (تناوب)از چپ به راست شعاع اتمی کاهش می یابد .
در یک دوره از چب به راست تعداد لایه های الکترونی ثابت است اما بارمؤثر هسته روی الکترون های لایه بیرونی افزایش می یابد در نتیجه شعاع اتمی کاهش می یابد.
در هر گروه از بالا به پایین شعاع اتمی افزایش می یابد .
در یک گروه از بالا به پایین تعداد لایه های الکترونی افزایش می یابد در نتیجه بارمؤثر هسته روی الکترون های لایه بیرونی کاهش می یابد و شعاع اتمی افزایش می یابد.
انرژی یونش :
مقدار انرژی لازم برای جدا کردن سست ترین الکترون ( بیرونی ترین الکترون ) یک عنصر گازی شکل و تبدیل آن به یون مثبت گازی.
انرژی نخستین یونش : انرژی لازم برای خارج کردن یک مول الکترون از یک مول اتم در حالت گازی که به تولید یک مول یون یک بار مثبت در حالت گازی است .
انرژی دومین یونش :انرژی لازم برای خارج کردن یک مول الکترون از یک مول یون یک بار مثبتدر حالت گازی و ایجاد یک مول یون دو بار مثبت در حالت گازی است .
روند تغییر انرژی نخستین یونش :
در هر دوره (تناوب) از چپ به راست انرژی نخستین یونش افزایش می یابد.
در یک تناوب از چپ به راست شعاع اتمی کاهش می یابد و جاذبه هسته بر الکترون های بیرونی افزایش می یابد و برای خارج کردن الکترون انرژی بیشتری لازم است .
در هر گروه از بالا به پایین انرژی نخستین یونش کاهش می یابد .
در یک گروه از بالا به پایین شعاع اتمی افزایش می یابد و جاذبه هسته بر الکترون های بیرونی کاهش می یابد و برای خارج کردن الکترون انرژی کمتری لازم است .
تغییرات انرژی یونش به چه عواملی بستگی دارد :
1-بار مؤثر هسته : بار مؤثر هسته سبب افزایش جاذبه بین الکترون و هسته می شود و جدا کردن الکترون مشکل تر و از این رو انرژی یونش زیاد می شود .
2-شعاع اتمی : با افزایش شعاع اتم جاذبه بین الکترون و هسته کاهش می یابد و در نتیجه جدا کردن الکترون آسان تر و انرژی یونش کاهش می یابد .
3- آرایش الکترونی اتم : هر چه آرایش الکترونی گونه مورد نظر متقارن باشد انرژی یونش افزایش می یابد .
بی نظمی در روند تغییر انرژی نخستین یونش :در یک دوره روند تغییرات انرژی یونش در گروه دوم وسیزدهم ونیز پانزدهم وشانزدهم انحراف وجود دارد.
الکترونگاتیوی:
به میزان تمایل نسبی اتم ها برای کشیدن الکترون های پیوندی به سمت هسته خود .
روند تغییر الکترونگاتیوی در جدول تناوبی :
در هر دوره (تناوب) از چپ به راست الکترونگاتیوی افزایش می یابد .
در یک تناوب از چپ به راست با افزایش بار مؤثر هسته جاذبه هسته بر الکترون های بیرونی افزایش می یابد و الکترون های پیوندی به هسته اتم نزدیک می شوند .
در هر گروه از بالا به پایین الکترونگاتیوی کاهش می یابد .
در یک گروه از بالا به پایین با کاهش بار مؤثر هسته جاذبه هسته بر الکترون های بیرونی کاهش می یابد و الکترون های پیوندی از هسته اتم دور می شوند .
دیدگاه
طبقه بندی موضوعی
- منابع کمک آموزشی وِیژه دروس عمومی کنکور (۵)
- منابع کمک آموزشی وِیژه دروس اختصاصی کنکور (۲۳)
- نحوه مطالعه دروس اختصاصی کنکور (۹)
- نحوه مطالعه دروس عمومی کنکور (۷)
- مشاوره (۷۸)
- دریافت جزوه (۷)
- معرفی رشته های علوم تجربی (۵)
- بودجه بندی دروس کنکور (۲)
- انگیزشى (۴۱)
- آرشیو کنکور های سراسری (۱)
- منابع درسی کنکور تجربی 96 (۲)
- آزمون های آزمایشی (۲)
- آرشیو امتحانات نهایی (۱)
- شرایط تحصیل مجدد (۲)
- اخبار و اطلاعیه ها (۱۰)
آخرين مطالب
-
راه اندازی نسخه جدید سایت
سه شنبه ۲۳ آذر ۱۳۹۵ -
تغییر سرورهای سایت
پنجشنبه ۱۸ آذر ۱۳۹۵ -
فرق بین تراز و رتبه
پنجشنبه ۱۸ آذر ۱۳۹۵ -
نمرۀ تراز چیست و چگونه محاسبه می شود؟
پنجشنبه ۱۸ آذر ۱۳۹۵ -
چگونه تست بزنیم؟
پنجشنبه ۱۸ آذر ۱۳۹۵ -
حکم دیوان عدالت در مورد محدودیت های پذیرش دانشجو در کنکور ۹۵
دوشنبه ۱۵ آذر ۱۳۹۵ -
دیدگاه
دوشنبه ۱۵ آذر ۱۳۹۵ -
چکار کنیم تا در کنکور و امتحانات وقت کم نیاوریم
دوشنبه ۱۵ آذر ۱۳۹۵ -
شرایط ترمیم دروس امتحان نهایی برای دبیرستانیها
يكشنبه ۱۴ آذر ۱۳۹۵ -
مبادا در یک قدمی موفقیت دست از تلاش بکشیم...
جمعه ۱۲ آذر ۱۳۹۵
پربازديدها
-
۴۵۲۴ -
۲۳۸۷ -
۱۹۵۹ -
۱۴۹۰ -
۱۶۱۸ -
۱۶۲۸ -
۱۲۳۹ -
۱۰۸۱ -
۹۲۴ -
۸۸۱