بایگانی
- آذر ۱۳۹۵ (۱۶)
- آبان ۱۳۹۵ (۳۸)
- مهر ۱۳۹۵ (۳۴)
- شهریور ۱۳۹۵ (۲۶)
- مرداد ۱۳۹۵ (۸)
- تیر ۱۳۹۵ (۱۴)
خلاصه آمار
پيوندها
۲۳ مطلب با موضوع «منابع کمک آموزشی وِیژه دروس اختصاصی کنکور» ثبت شده است
چکیده نکات زیست شناسی ویژه کنکور
منابع کمک آموزشی وِیژه دروس اختصاصی کنکور
نکات زیست شناسی سال دوم، سوم و پیش دانشگاهی - ویژه مرور و تسلط
|
مهمترین پنتوز ها: ریبوز و دئوکسی ریبوز |
|
بیشترین ترکیب آلی طبیعت: سلولز |
|
بیشترین تعداد مولکول های غشاء: فسفولیپیدها |
|
مهمترین پروتئین ها: آنزیم ها |
|
مهمترین ابزارهای سلول : آنزیم ها |
|
بیشترین ترکیب بدن: آب |
|
بیشترین ترکیب آلی بدن: پروتئین ها |
|
مهمترین تولید کننده پروتئازها: روده |
|
مهمترین تولید کننده لیپازها: پانکراس |
|
کوچکترین سلول: باکتری |
|
کوچکترین سلول یوکاریوت: اریتروسیت |
|
درازترین سلول ها: عصبی و ماهیچه ای |
|
بزرگترین سلول یوکاریوت: تخم پرندگان |
|
آشکارترین تفاوت سلول های پروکاریوتی و یوکاریوتی: وجود اندامک های غشادار درون سلولی در یوکاریوت ها |
|
ساده ترین جانداران پرسلولی: کلنی ها |
|
ساده ترین نوع تولید مثل: تقسیم دوتایی باکتری |
|
ساده ترین نوع زایش در : ولوکس |
|
ساده ترین بافت بدن: پوششی |
|
سخت ترین بافت بدن: استخوان |
|
بیشترین وزن بدن ،بافت: ماهیچه ای |
|
مهمترین مناطق مریستمی گیاهان علفی و جوان: مریستم های رأسی |
|
از مهمترین کارهای شبکه آندوپلاسمی صاف: ساختن اسیدهای چرب، استروئیدها،فسفولیپیدها |
|
جایگاه بیشترین ماده ژنتیک سلول های یوکاریوتی: هسته |
|
کوچکترین و ساده ترین ریبوزوم ها: ریبوزوم های پروکاریوت ها ،میتوکندری،کلروپلاست |
|
بیشترین فضای بین سلولی در گیاهان: سلول های پارانشیمی |
|
کمترین فضای بین سلولی در گیاهان: سلول های مریستمی |
|
ضخیم ترین دیواره نخستین در بافت: کلانشیم |
|
بیشترین تعداد میتوکندری در یک سلول گیاهی: در سلول همراه |
|
بزرگترین واکوئل در سلول گیاهی: پارانشیم بالغ و سلول آبکشی |
|
متنوع ترین اعمال سلولی در گیاهان در سلول های: پارانشیمی |
|
بیشترین انواع سلول در یک بافت گیاهی: بافت آبکشی |
|
بزرگترین جانور کره زمین: وال |
|
قوی ترین ماهیچه صاف لوله ی گوارش: ماهیچه های دریچه پیلور |
|
قوی ترین آنزیم های لوله گوارش: آنزیم های برون ریز پانکراس |
|
مهمترین عامل مؤثر بر تخلیه معده: ترکیب شیمیایی و حجم کیموس موجود در دوازدهه |
|
ترشحات نزدیکترین غدد به پیلور: آنزیم های شیره معده و گاسترین |
|
طویل ترین لوله ی گوارش در : گیاهخواران |
|
کاراترین دستگاه گوارش بین گیاهخواران: نشخوارکنندگان |
|
شدیدترین میل ترکیبی با هموگلوبین: مونواکسید کربن |
|
بیشترین حجم خون بدن در: سیاهرگ ها |
|
بیشترین سرعت خون بدن در : سرخرگها (آئورت) |
|
کمترین نفوذپذیری مویرگ ها: مویرگ های مغز |
|
بیشترین طول عمر بین سلول های خونی: ماکروفاژها |
|
مهمترین نقش ریشه: جذب آب و مواد معدنی محلول در خاک |
|
سمی ترین ماده دفعی نیتروژن دار: آمونیاک |
|
بیشترین نیاز به آب برای دفع بین مواد زائد نیتروژن دار: آمونیاک |
|
بیشترین نیاز به انرژی برای دفع بین مواد زائد نیتروژن دار: اوریک اسید |
|
پیچیده ترین فرمول بین مواد دفعی نیتروژن دار: اوریک اسید |
|
مهمترین عامل ایجاد فشار ریشه ای: دایره محیطیه |
|
بارزترین نشانه ی فشار ریشه ای: تعریق |
|
مهمترین عامل در تعیین نوع ماده دفعی جانور: زیستگاه جانور |
|
بیشترین مواد دفعی گیاهان : آب، اکسیژن، کربن دی اکسید |
|
مناسب ترین مایع برای کاهش اصطکاک میان دو سطح: مایع مفصلی |
|
ساده ترین روش مبارزه ی پادتن: چسبیدن به آنتی ژن سطح میکروب |
|
بزرگترین بخش مغز: مخ |
|
مهمترین مرکز هماهنگی و یادگیری حرکات لازم برای تعادل: مخچه |
|
بیشترین اندازه ی نسبی مغز در بین مهره داران: پرندگان و پستانداران |
|
ساده ترین دستگاه عصبی : هیدر |
|
پیچیده ترین رفتارها در بین مهره داران : پرندگان و پستانداران |
|
بیشترین چین خوردگی قشر مخ در : انسان |
|
بیشترین قابلیت مغز برای انجام فعالیت های پیچیده تر مثل تفکر و حل مسئله: انسان |
|
قطورترین لایه چشم: صلبیه |
|
خارجی ترین لایه چشم: صلبیه |
|
نازک ترین لایه چشم: شبکیه |
|
داخلی ترین لایه چشم: شبکیه |
|
بیشترین حساسیت به شیرینی: نوک زبان |
|
بیشترین حساسیت به شوری: کناره های زبان روبه جلو |
|
بیشترین حساسیت به ترشی: کناره های زبان رو به عقب |
|
بیشترین حساسیت به تلخی: عقب زبان |
|
بیشترین حساسیت به نور در شبکیه چشم: سلول های استوانه ای |
|
کمترین حساسیت به نور در شبکیه چشم: سلول های مخروطی |
|
بیشترین تحریک در نور قوی: سلول های مخروطی |
|
بیشترین تحریک در نور ضعیف: سلول های استوانه ای |
|
حساس ترین گیرنده شیمیایی در: شاخک نوعی پروانه ی ابریشم نر |
|
ساده ترین گیرنده ی نوری در : چشم جامی شکل پلاناریا |
|
بیشترین تعداد هورمون های هیپوفیز از: هیپوفیز پیشین |
|
سریعترین پاسخ به فشار روحی –جسمی در : اعصاب سمپاتیک |
|
کندترین پاسخ به فشار روحی- جسمی در هورمون های : بخش قشری فوق کلیه |
|
بیشترین دوام در پاسخ به فشار روحی- جسمی در هورمون های: بخش قشری فوق کلیه |
|
کمترین دوام در پاسخ به فشار روحی-جسمی در :اعصاب سمپاتیک |
|
شایع ترین نوع دیابت شیرین: دیابت نوع دو یا غیر وابسته به انسولین |
|
بیشترین فشردگی کروموزوم در مرحله ی: متافاز |
|
کمترین طول کروموزوم در مرحله : متافاز |
|
کمترین فشردگی کروموزوم در زمان میتوز در مرحله : تلوفاز |
|
بیشترین طول کروموزوم در زمان میتوز در مرحله : تلوفاز |
|
ساده ترین چرخه زندگی : هاپلوئیدی |
|
بارزترین ویژگی چرخه ی زندگی دیپلوئیدی: جاندار پرسلولی فقط دیپلوئید باشد. |
|
مناسب ترین روش برای نتایج حاصل از آمیزش دلخواه: مربع پانت |
|
ساده ترین شکل مربع پانت: 4 خانه ای |
|
بزرگترین جاندار کره زمین: سکویا |
|
موفق ترین گیاهان برای زندگی در خشکی: گیاهان دانه دار |
|
خارجی ترین حقه گل: کاسبرگ |
|
داخلی ترین حلقه گل: مادگی |
|
کوچکترین اسپوروفیت در: خزه گیان |
|
بزرگترین اسپوروفیت در : نهاندانگان |
|
کوچکترین گامتوفیت در : نهاندانگان |
|
بزرگترین گامتوفیت در : خزه گیان |
|
مسن ترین درخت: نوعی کاج 5000 ساله |
|
بیشترین قطر عناصر آوند چوبی در : فصل بهار |
|
کمترین قطر عناصر آوند چوبی در : فصل تابستان |
|
مهمترین نقش هورمون آبسیزیک اسید : خفتگی دانه و جوانه |
|
بیشترین اندوخته غذایی تخمک در : تخمک پرندگان |
|
کامل ترین نوع تولید مثل جنسی در : پستانداران جفت دار |
|
بیشترین میزان LH چرخه تخمدان در زمان : تخمک گذاری |
|
مهمترین وقایع نمو در سه ماهه ی : اول بارداری |
|
بهترین فایده ی سونوگرافی: بی ضرر بودن آن |
|
داخلی ترین پرده جنین: آمنیون |
|
داخلی ترین لایه ی بافت مقدماتی رویان : آندودرم |
|
خارجی ترین لایه ی بافت مقدماتی رویان: اکتودرم |
|
بیشترین فرصت برای تنظیم بیان ژن در سلول های : یوکاریوتی |
|
مهمترین هدف مهندسی ژنتیک: تولید ژن و یا محصولات آن به مقدار انبوه |
|
مهمول ترین وکتورها: پلازمیدها و ویروس ها |
|
قدیمی ترین جانداران : پروکاریوت ها 3.5 میلیارد ساله |
|
قدیمی ترین سنگواره کشف شده: سنگواره ی میکروسکوپی پروکاریوت های |
|
مخرب ترین انقراض گروهی: انقراض سوم (245) میلیون سال قبل |
|
فراوان ترین جانوران: حشرات |
|
متنوع ترین جانوران: حشرات |
|
موفق ترین مهره داران زنده: ماهی های آرواره دار |
|
موفق ترین مهره داران خشکی، قبل از انقراض پنجم: خزندگان |
|
موفق ترین مهره داران بعد از انقراض پنجم: پرندگان و پستانداران |
|
مستقیم ترین شواهد تغییر گونه ها در : سنگواره ها |
|
مهمترین نقش جهش : ایجاد تنوع |
|
شدید ترین حالت درون آمیزی: خود لقاحی |
|
بهترین و موفق ترین شایستگی تکاملی دارای عدد : یک است |
|
مهمترین عامل جدایی گونه های شبیه به هم: جدایی رفتاری |
|
مهمترین عامل جدایی گونه های با ظاهر متفاوت: جدایی مکانیکی |
|
آشکارترین نمونه گونه زایی هم میهنی: پیدایش گیاهان پلی پلوئید |
|
از مهمترین ویژگی های جمعیت : اندازه ی جمعیت |
|
مهمترین ایراد الگوی رشد نمایی: نامحدود در نظر گرفتن منابع |
|
مهمترین ایراد سوپ بنیادین: عدم تشکیل مولکول های پایه ای حیات |
|
اصلی ترین عامل محدود کننده اندازه ی جمعیت: شکار شدن توسط گونه های دیگر |
|
مهمترین جنبه ی مقایسه ی جمعیت های تعادلی و فرصت طلب: نوع اثر انتخاب طبیعی بر روی آن ها |
|
بهترین راهبرد تولید مثلی برای جمعیت های تعادلی: ایجاد فرزندانی با قابلیت رقابتی بالا |
|
از پیچیده ترین راه های دفاعی همه ی گیاهان : ترکیبات ثانوی |
|
ساده ترین نوع یادگیری: عادی شدن |
|
سریعترین راه برقراری ارتباط جانور با محیط: رفتار |
|
ابتدایی ترین راه ارتباطی بین جانوران: مواد شیمیایی |
|
پیچیده ترین راه ارتباطی بین جانوران: علائم صوتی |
|
مهمترین عامل تعیین کننده ی راهبردهای تولید مثلی: هزینه ی پرداختی والدین برای تولید مثل و نگهداری از فرزندان |
|
رایج ترین روش تثبیت کربن دی اکسید در جانداران کلروفیل دار: چرخه ی کالوین |
|
محسوس ترین عامل مؤثر بر فتوسنتز: نور |
|
کاراترین گیاهان در دمای بالا و نور زیاد : گیاهان C4 |
|
آخرین پذیرنده الکترون در زنجیره ی انتقال الکترون میتوکندری: اکسیژن |
|
کوچکترین موجود زنده: باکتری |
|
کارامدترین شکل کپسید: کپسید با 20 وجه مثلثی شکل |
|
اصلی ترین تجزیه کنندگان اکوسیستم ها: قارچ ها و باکتری های هتروتروف |
|
رایج ترین شکل نیتروژن مورد استفاده گیاهان: نیترات |
|
مهمترین تثبیت کننده نیتروژن: ریزوبیوم ها |
|
عامل ایجاد شایع ترین نوع مسمومیت غذایی: استافیلوکووس اورئوس |
|
عامل ایجاد کشنده ترین نوع مسمومیت غذایی: کلستریدیوم بوتولینم |
|
ابتدایی ترین یوکاریوت ها: آغازیان |
|
بزرگترین آغازیان: کلپ |
|
پیچیده ترین آغازیان: مژکداران |
|
غیر معمول ترین آغازیان: مژکداران |
|
بزرگترین فتوسنتز کنندگان: آغازیان |
|
قدیمی ترین جانداران سطح خشکی ها: گلسنگ ها |
|
مهمترین بخش دومین خط دفاع غیر اختصاصی: گلبول های سفید |
دانلود جزوه فیزیک جامع کنکور
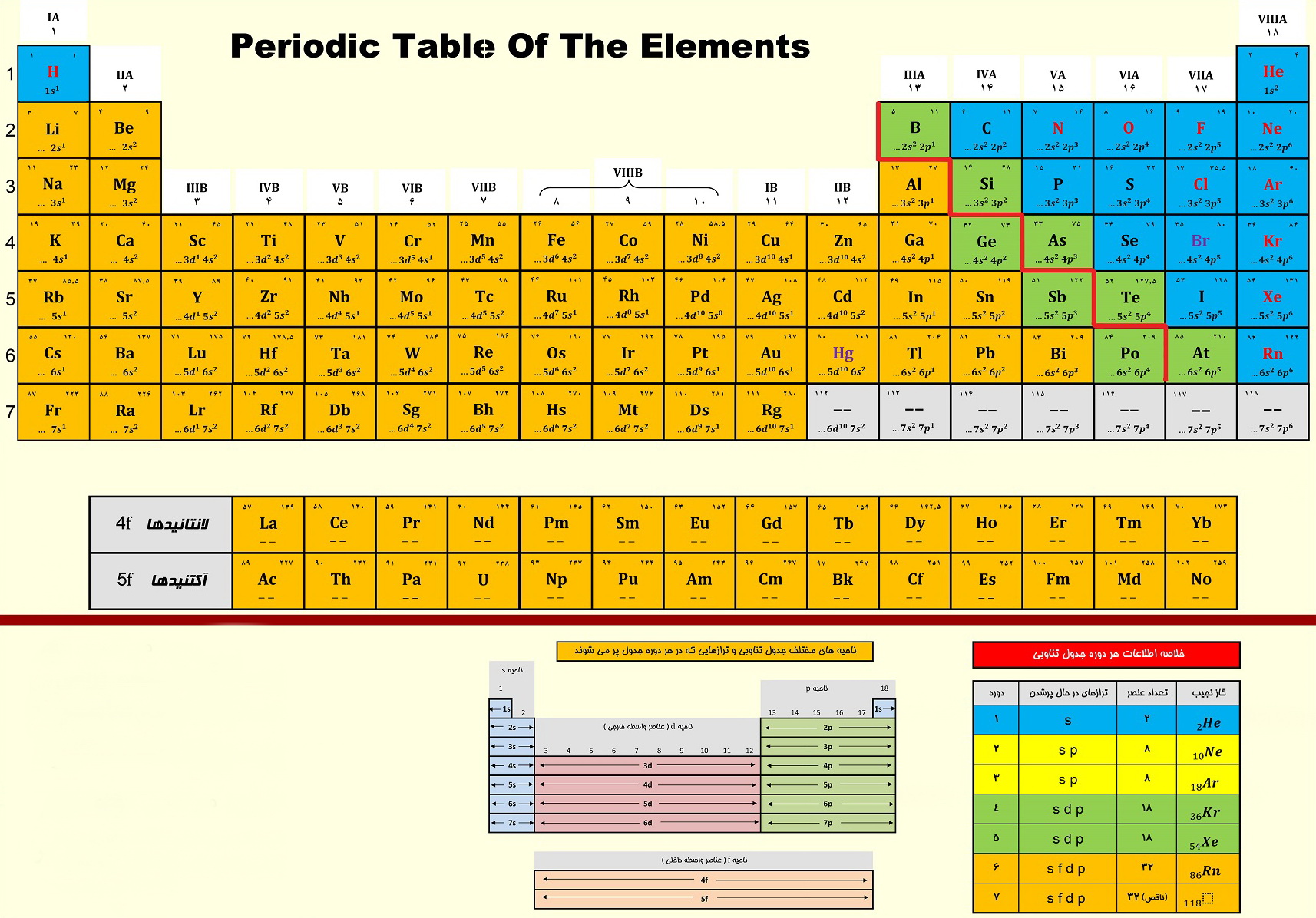
همه چیز درباره جدول تناوبی عناصر، ویژه کنکور
منابع کمک آموزشی وِیژه دروس اختصاصی کنکور
تغییرات خواص عناصر در دوره ها و گروه های جدول:
1) در هر گروه از جدول تناوبی از بالا به پایین شعاع اتمی ویونی افزایش می یابد. از چپ به راست در هر تناوب کاهش می یابد.
2) در هر گروه از جدول تناوبی از بالا به پایین برخصلت فلزی عناصر افزوده و از چپ به راست خصلت فلزی کاسته می شود.
3) در هر گروه از جدول تناوبی از بالا به پایین بار مؤثر هسته افزایش می یابد. همواره بین شعاع با بار مؤثر هسته و نیز انرژی یونش رابطه ی وارونه وجود دارد.
4) در هر گروه از جدول تناوبی از بالا به پایین اثر پوششی الکترون های درونی زیاد می شود. در هر دوره از چپ به راست تعداد لایه های الکترونی و نیز میزان اثر پوششی الکترون های درونی ثابت می ماند.
5) در هر گروه از جدول تناوبی از بالا به پایین با افزایش اندازه اتم، انرژی یونش کاهش می یابد. و در هر دوره از چپ به راست انرژی یونش افزایش می یابد. در یک دوره کمترین انرژی یونش مربوط به فلزات قلیایی و بیشترین انرژی یونش مربوط به گازهای نجیب می باشد.
6) در هر گروه از جدول تناوبی از بالا به پایین مقدار الکترونگاتیوی کاهش می یابد و در هر دوره از چپ به راست الکترونگاتیوی افزایش می یابد. بیشترین الکترونگاتیوی مربوط به فلوئور (4) و کمترین الکترونگاتیوی از آن سزیم (0/7) است.
7) تغییرات دمای ذوب یا جوش: در هر دوره دمای ذوب و جوش تا اندازه ای به طور تناوبی تغییر می کند ولی این روند منظم نیست و در مورد عناصرگروه ها نیز روند واحدی وجود ندارد.
8) در هر دوره با افزایش عدد اتمی انرژی الکترون خواهی افزایش می یابد و در هر گروه با افزایش عدد اتمی اصولا انرژی الکترون خواهی از بالا به پایین کم می شود .
9) تغییر تعداد الکترون های لایه ظرفیت و عدد اکسایش: در هر دوره از عنصری به عنصر دیگر یک واحد به تعداد الکترون های ظرفیت افزوده می شود و تعداد این الکترون ها و عدد اکسایش در عنصرهای هر گروه با هم برابرند.
10) تغییرات پتانسیل الکترودی: در ازای هر دوره با افزایش عدد اتمی توانایی کاهندگی عنصرها کاهش می یابد و توانایی اکسیدکنندگی آنها افزایش می یابد. از این رو فلزهایی که در سمت چپ دوره ها جای دارند خاصیت کاهندگی و نا فلزهایی که در سمت راست دوره ها جای دارند توانایی اکسیدکنندگی دارند. در مورد عناصر یک گروه توانایی اکسیدکنندگی با افزایش عدد اتمی و پتانسیل کاهش می یابد.
11) تغییرات توانایی بازی هیدروکسید: توانایی بازی هیدروکسید عناصر در گروه ها از بالا به پایین افزایش می یابد اما در دوره از سمت چپ به راست رو به کاهش است.
12) در یک دوره روند تغییرات انرژی یونش در گروه دوم و سیزدهم و نیز پانزدهم و شانزدهم انحراف وجود دارد.
13) در فلزات قلیایی از بالا به پایین واکنش پذیری افزایش می یابد.
14) دوره ی اول جدول تناوبی با 2 عنصرکوتاه ترین دوره و دوره ششم به 32 عنصر بلند ترین دوره جدول می باشد. بلندترین گروه جدول تناوبی: گروه سوم با 32 عنصر است.
15) گروه هالوژن ها تنها گروهی از جدول تناوبی که به هر سه حالت جامد، مایع وگاز وجود دارند.
کوتاه اما خواندنی:
سبکترین ذره زیر اتمی : الکترون
واکنش پذیرترین فلزها : فلزهای قلیایی
واکنش پذیرترین نافلزها : هالوژنها
سبکترین فلز : لیتیم
مشهورترین فلز قلیایی خاکی : کلسیم
مشهورترین اکتنید : اورانیم
فراوانترین عنصرهای موجود در پوسته زمین : سیلیسیم و اکسیژن
فراوانترین فلز هسته ی زمین: آلومینیوم.
فراوانترین عنصر جهان : هیدروژن
فراوانترین ترکیب هیدروژن : آب
سبکترین عنصر : هیدروژن
کمترین الکترونگاتیوی : سزیم
بیشترین الکترونگاتیوی : فلوئور
کمترین انرژی نخستین یونش : سزیم
بیشترین انرژی نخستین یونش : هلیم
ساده ترین ترکیب های آلی : هیدروکربنها
ساده ترین هیدروکربنها : الکانها
اربیتال با کمترین انرژی در هر تراز انرژی : اربیتال کروی S
اتم هیدروژن تنها اتمی است که هسته ی آن فاقد نوترون می باشد.
گازهای نجیب به طور کلی واکنش ناپذیرترین عناصر جدول می باشند.
فلوئور واکنش پذیرترین نافلز و بیشترین الکترونگاتیوی را دارد.
تنها فلز مایع: جیوه و تنها نافلز مایع: برم .
مهمترین نکته در جدول تناوبی : تشابه آرایش الکترونی عنصرهای یک خانواده در بسیاری گروه های جدول
شعاع اتمی: هیدروژن با شعاع اتمی 37 پیکومتر کوچکترین و فرنسیم با شعاع اتمی 283 پیکومتربزرگترین شعاع را دارد و بعد از هیدروژن، فلئورکوچکترین شعاع را دارد.
سبک ترین و سنگین ترین عناصر: اسمیم با چگالی 22.48 گرم بر سانتیمتر مکعب سنگین ترین عنصر و هیدروژن با چگالی 0.0899 گرم بر لیتر سبکترین عنصر است.این عنصر به علت سبک بودن در جو زمین یافت نمی شود.
دمای ذوب وجوش: هلیم پایین ترین دمای ذوب( 272.2 - درجه سلسیوس ) و پایین ترین دمای جوش( 268.9 درجه سلسیوس) و تنگستن بالاترین دمای ذوب( 3409 درجه سلسیوس) وبالاترین دمای جوش 5659 درجه سلسیوس) را دارد.
رسانایی الکتریکی و قابلیت تورق: این خواص به عناصر فلزی مربوط می شود و در بین فلزات طلا بیشترین رسانایی الکتریکی و بیشترین قابلیت تورق را دارد. با یک گرم طلا می توان ورقه ای با سطح یک متر مربع ساخت است که ضخامت آن تنها 230 اتم باشد این خواص زاییده آرایش الکترونی این عناصر می باشد.
آلوتروپی: بسیاری از عناصر دارای آلوتروپ هستند که از بین آنها گوگرد بیشترین آلوتروپ را دارد(حدود 14 عدد)کربن ،فسفر و بور نیز مانند گوگرد دارای آلوتروپ هستند.
الکترونگاتیوی: فلئور بیشترین و سزیم کمترین الکترونگاتیوی را دارد .در بین فلزات طلا بیشترین الکترونگاتیوی ( 2.4 ) را داردکه حدود الکترونگاتیوی گوگرد و ید است به همین دلیل اخیرا ترکیباتی مانندCs+ وAu- ساخته شده است.
عنصری که بیشترین تعداد ترکیبات را دارد: هیدروژن (در ترکیبات آلی و معدنی) و پس از آن کربن (در ترکیبات آلی)است.
بیشترین ایزوتوپ: زنون دارای بیشترین تعداد ایزوتوپ می باشد ( 26 عدد) که عدد جرمی آنها از 118 تا 143 تغییر می کند.
خطرات : فلئور و کلر سمی اند. فسفر، هیدروژن و فلزات قلیایی آتشگیر و برم خورنده است.Cr, Ni, As, Cd می توانند باعث ایجاد سرطان گردند. عناصر اکتنید و همچنین کاتیون های عناصر Po, At, Rn, Fr, Ra, Pm پرتوزایند.
وفور در قشر زمین: از بین همه عناصر فقط 7 عنصر دارای وفور بیش از 1% هستند که عبارتند از: O, Si, Fe, Al, Ca, Mg, Na (اکسیژن از همه عناصر بیشتر است و حدود 45.5 % قشر زمین است). Tc, Pm و عناصر با عدد اتمی 93 به بالا در زمین یافت نمی شوند.
بالاترین رسانایی گرمایی،سختی و انبساط طولی: انتظار می رود که این سه خاصیت به فلزات تعلق داشته باشد ولی الماس با ساختمان مشبک بیشترین رسانایی گرمایی را دارد .( پنج برابر فلز مس) به همین دلیل مته ها و اره های ساخته شده از الماس بیش از حد داغ نمی شوند. علاوه براین الماس سخت ترین ماده شناخته شده و کمترین ضریب انبساط طولی را دارد.در صورتی که پتاسیم و روبیدیم بیشترین انبساط را در اثر گرما پیدا می کنند.
بیشترین نیم عمر: تمام ایزوتوپ های اکتنید ها پرتوزایند و از میان آنها عناصر توریم و اورانیوم به ترتیب بیشترین نیم عمرها را دارند.
قدیمی ترین عناصر: قدیمی ترین عناصرهفت فلز معروف یعنی آهن،مس،نقره ،طلا ،قلع ،سرب و جیوه هستند که در دوران باستان کشف شده اند علاوه بر انها دو عنصر کربن و گوگرد نیز به عناصر دوران باستان تعلق دارند.
آشنایی با چند مفهوم ساده در شیمی
منابع کمک آموزشی وِیژه دروس اختصاصی کنکور
خاصیت فلزی و نافلزی :
در هر دوره از چپ به راست خاصیت فلزی کاهش می یابد و خاصیت نافلزی افزایش می یابد. به بیان بهتر در هر دوره با افزایش عدد اتمی واکنش پذیری فلز کاهش می یابد و واکنش پذیری نافلز افزایش می یابد .
همچنین در هر گروه از بالا به پایین خاصیت فلزی افزایش و خاصیت نافلز کاهش می یابد. یعنی از بالا به پایین واکنش پذیری فلز افزایش می یابد و واکنش پذیری نافلز کاهش می یابد .
بار مؤثر هسته :
به بار مثبتی که یک الکترون در فاصله معینی از هسته احساس می کند بار موثر هسته برای آن الکترون گویند.
روند تغییرات بار مؤثر هسته ی اتم در جدول :
در هر دوره (تناوب) از چپ به راست بار موثر هسته روی الکترون های بیرونی افزایش می یابد : چون از چپ به راست عدد اتمی افزایش می یابد ولی اثر پوششی الکترون های درونی تغییر نمی کند در نتیجه جاذبه هسته بر الکترون های لایه ظرفیت بیشتر می شود
در هر گروه از بالا به پایین بار موثر هسته افزایش می یابد : چون از بالا به پایین عدد اتمی افزایش می یابد ( اثر آن روی بار مؤثر به اندازه اثر پوششی الکترون های درونی نیست ) و از طرفی اثر پوششی الکترون های درونی افزایش می یابد در نتیجه جاذبه هسته بر الکترون های لایه ظرفیت کاهش می یابد .
اثر پوششی:
الکترونی که در لایه بیرونی قرار دارد تمام بار هسته را احساس نمی کند زیرا الکترون های لایه درونی مقداری از جاذبه هسته بر الکترون های لایه ظرفیت می کاهند (به عبارت دیگر به کاهش جاذبه هسته بر الکترون های لایه ظرفیت توسط الکترون های لایه درونی).
در هر گروه از جدول تناوبی از بالا به پایین اثر پوششی الکترون های درونی زیاد می شود. در هر دوره از چپ به راست تعداد لایه های الکترونی و همچنبن میزان اثر پوششی الکترون های درونی ثابت می ماند.
شعاع اتمی ( اندازه اتم ):
شعاع اتمی یک عنصر شیمیایی معیاری برای اندازهگیری اندازه اتم است که عموماً فاصله میانگین هسته تا مرز ابر الکترونی در نظر گرفته میشود. الکترونها در محدودههایی حرکت میکنند که شبیه ابر به نظر میرسد. همین نشان دهنده دشواری اندازهگیری شعاع اتمی خواهد بود، زیرا این مرز مشخص نیست.
عوامل مؤثر بر شعاش اتمی :
1- تعداد لایه های الکترونی : هر چه تعداد لایه های الکترونی بیشتر باشد شعاع اتمی بیشتر و بر عکس
2- بار مؤثر هسته : هر چه بارمؤثر هسته روی الکترون های لایه بیرونی بیشتر باشد این الکترون ها بیشتر به سمت هسته کشیده می شوند و شعاع اتمی کاهش می یابد .
روند تغییرات شعاع اتمی در جدول :
در هر دوره (تناوب)از چپ به راست شعاع اتمی کاهش می یابد .
در یک دوره از چب به راست تعداد لایه های الکترونی ثابت است اما بارمؤثر هسته روی الکترون های لایه بیرونی افزایش می یابد در نتیجه شعاع اتمی کاهش می یابد.
در هر گروه از بالا به پایین شعاع اتمی افزایش می یابد .
در یک گروه از بالا به پایین تعداد لایه های الکترونی افزایش می یابد در نتیجه بارمؤثر هسته روی الکترون های لایه بیرونی کاهش می یابد و شعاع اتمی افزایش می یابد.
انرژی یونش :
مقدار انرژی لازم برای جدا کردن سست ترین الکترون ( بیرونی ترین الکترون ) یک عنصر گازی شکل و تبدیل آن به یون مثبت گازی.
انرژی نخستین یونش : انرژی لازم برای خارج کردن یک مول الکترون از یک مول اتم در حالت گازی که به تولید یک مول یون یک بار مثبت در حالت گازی است .
انرژی دومین یونش :انرژی لازم برای خارج کردن یک مول الکترون از یک مول یون یک بار مثبتدر حالت گازی و ایجاد یک مول یون دو بار مثبت در حالت گازی است .
روند تغییر انرژی نخستین یونش :
در هر دوره (تناوب) از چپ به راست انرژی نخستین یونش افزایش می یابد.
در یک تناوب از چپ به راست شعاع اتمی کاهش می یابد و جاذبه هسته بر الکترون های بیرونی افزایش می یابد و برای خارج کردن الکترون انرژی بیشتری لازم است .
در هر گروه از بالا به پایین انرژی نخستین یونش کاهش می یابد .
در یک گروه از بالا به پایین شعاع اتمی افزایش می یابد و جاذبه هسته بر الکترون های بیرونی کاهش می یابد و برای خارج کردن الکترون انرژی کمتری لازم است .
تغییرات انرژی یونش به چه عواملی بستگی دارد :
1-بار مؤثر هسته : بار مؤثر هسته سبب افزایش جاذبه بین الکترون و هسته می شود و جدا کردن الکترون مشکل تر و از این رو انرژی یونش زیاد می شود .
2-شعاع اتمی : با افزایش شعاع اتم جاذبه بین الکترون و هسته کاهش می یابد و در نتیجه جدا کردن الکترون آسان تر و انرژی یونش کاهش می یابد .
3- آرایش الکترونی اتم : هر چه آرایش الکترونی گونه مورد نظر متقارن باشد انرژی یونش افزایش می یابد .
بی نظمی در روند تغییر انرژی نخستین یونش :در یک دوره روند تغییرات انرژی یونش در گروه دوم وسیزدهم ونیز پانزدهم وشانزدهم انحراف وجود دارد.
الکترونگاتیوی:
به میزان تمایل نسبی اتم ها برای کشیدن الکترون های پیوندی به سمت هسته خود .
روند تغییر الکترونگاتیوی در جدول تناوبی :
در هر دوره (تناوب) از چپ به راست الکترونگاتیوی افزایش می یابد .
در یک تناوب از چپ به راست با افزایش بار مؤثر هسته جاذبه هسته بر الکترون های بیرونی افزایش می یابد و الکترون های پیوندی به هسته اتم نزدیک می شوند .
در هر گروه از بالا به پایین الکترونگاتیوی کاهش می یابد .
در یک گروه از بالا به پایین با کاهش بار مؤثر هسته جاذبه هسته بر الکترون های بیرونی کاهش می یابد و الکترون های پیوندی از هسته اتم دور می شوند .
طبقه بندی موضوعی
- منابع کمک آموزشی وِیژه دروس عمومی کنکور (۵)
- منابع کمک آموزشی وِیژه دروس اختصاصی کنکور (۲۳)
- نحوه مطالعه دروس اختصاصی کنکور (۹)
- نحوه مطالعه دروس عمومی کنکور (۷)
- مشاوره (۷۸)
- دریافت جزوه (۷)
- معرفی رشته های علوم تجربی (۵)
- بودجه بندی دروس کنکور (۲)
- انگیزشى (۴۱)
- آرشیو کنکور های سراسری (۱)
- منابع درسی کنکور تجربی 96 (۲)
- آزمون های آزمایشی (۲)
- آرشیو امتحانات نهایی (۱)
- شرایط تحصیل مجدد (۲)
- اخبار و اطلاعیه ها (۱۰)
آخرين مطالب
-
راه اندازی نسخه جدید سایت
سه شنبه ۲۳ آذر ۱۳۹۵ -
تغییر سرورهای سایت
پنجشنبه ۱۸ آذر ۱۳۹۵ -
فرق بین تراز و رتبه
پنجشنبه ۱۸ آذر ۱۳۹۵ -
نمرۀ تراز چیست و چگونه محاسبه می شود؟
پنجشنبه ۱۸ آذر ۱۳۹۵ -
چگونه تست بزنیم؟
پنجشنبه ۱۸ آذر ۱۳۹۵ -
حکم دیوان عدالت در مورد محدودیت های پذیرش دانشجو در کنکور ۹۵
دوشنبه ۱۵ آذر ۱۳۹۵ -
دیدگاه
دوشنبه ۱۵ آذر ۱۳۹۵ -
چکار کنیم تا در کنکور و امتحانات وقت کم نیاوریم
دوشنبه ۱۵ آذر ۱۳۹۵ -
شرایط ترمیم دروس امتحان نهایی برای دبیرستانیها
يكشنبه ۱۴ آذر ۱۳۹۵ -
مبادا در یک قدمی موفقیت دست از تلاش بکشیم...
جمعه ۱۲ آذر ۱۳۹۵
پربازديدها
-
۴۴۸۹ -
۲۳۸۶ -
۱۹۵۹ -
۱۴۸۷ -
۱۶۱۸ -
۱۶۲۸ -
۱۲۳۹ -
۱۰۸۱ -
۹۲۳ -
۸۸۱